Las vacunas de ARNm han demostrado recientemente ser altamente efectivas contra el SARS-CoV-2. La clave de su éxito es la nanopartícula basada en lípidos (LNP), que permite una expresión eficiente de ARNm y dota a la vacuna de propiedades adyuvantes que impulsan potentes respuestas de anticuerpos. Las vacunas efectivas contra el cáncer requieren respuestas cualitativas de células T CD8 de larga duración en lugar de respuestas de anticuerpos. La vacunación sistémica parece ser la ruta más efectiva, pero requiere la adaptación de la composición de LNP para entregar ARNm a las células presentadoras de antígenos. Utilizando una metodología de diseño de experimentos, adaptamos composiciones de mRNA-LNP para lograr respuestas de células T CD8 específicas de tumor de alta magnitud dentro de una sola ronda de optimización. Las composiciones de LNP optimizadas dieron como resultado una captación de ARNm mejorada por múltiples poblaciones de células inmunitarias esplénicas. Se encontró que el interferón tipo I y los fagocitos son esenciales para la respuesta de las células T. Sorprendentemente, también descubrimos un papel aún no identificado de las células B en la estimulación de la respuesta de las células T CD8 provocada por la vacuna. Los LNP optimizados mostraron un perfil de biodistribución centrado en el bazo similar en primates no humanos y no desencadenaron cambios histopatológicos en el hígado y el bazo, lo que justifica su evaluación adicional en estudios clínicos. En conjunto, nuestro estudio aclara la relación entre la composición de las nanopartículas y su capacidad estimuladora de células T y proporciona nuevos conocimientos sobre los mecanismos subyacentes de la inmunoterapia antitumoral eficaz basada en mRNALNP. Los LNP optimizados mostraron un perfil de biodistribución centrado en el bazo similar en primates no humanos y no desencadenaron cambios histopatológicos en el hígado y el bazo, lo que justifica su evaluación adicional en estudios clínicos. En conjunto, nuestro estudio aclara la relación entre la composición de las nanopartículas y su capacidad estimuladora de células T y proporciona nuevos conocimientos sobre los mecanismos subyacentes de la inmunoterapia antitumoral eficaz basada en mRNALNP. Los LNP optimizados mostraron un perfil de biodistribución centrado en el bazo similar en primates no humanos y no desencadenaron cambios histopatológicos en el hígado y el bazo, lo que justifica su evaluación adicional en estudios clínicos. En conjunto, nuestro estudio aclara la relación entre la composición de las nanopartículas y su capacidad estimuladora de células T y proporciona nuevos conocimientos sobre los mecanismos subyacentes de la inmunoterapia antitumoral eficaz basada en mRNALNP.
INTRODUCCIÓN
Las vacunas de ARN mensajero (ARNm) son extremadamente versátiles, ya que las secuencias de ARNm se pueden adaptar fácilmente para codificar cualquier antígeno de interés, lo que permite el desarrollo de vacunas rápidas y a gran escala contra patógenos emergentes, así como el diseño de vacunas personalizadas contra el cáncer. La clave del éxito de las vacunas de ARNm contra el SARS-CoV2 actualmente aprobadas y de muchas vacunas profilácticas basadas en ARNm en desarrollo clínico son las nanopartículas basadas en lípidos (LNP), vehículos de administración que median la expresión eficiente de ARNm in situ y dotan a la vacuna de propiedades adyuvantes intrínsecas .
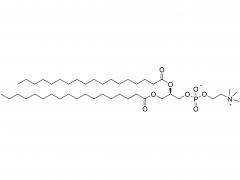
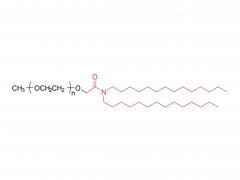
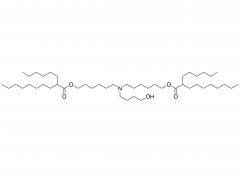
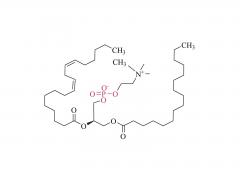
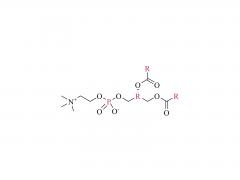
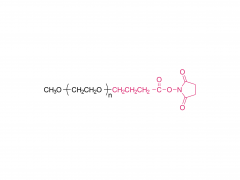
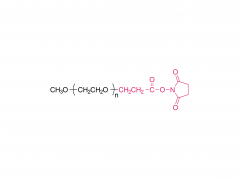
Los LNP están compuestos por un lípido ionizable, un fosfolípido, colesterol y un lípido pegilado, y el lípido ionizable se considera el impulsor más importante de la expresión del ARNm. A diferencia de sus predecesores que tienen una carga catiónica en una amplia variedad de rangos de pH, los lípidos ionizables son lípidos sensibles al pH que dotan a los LNP de una carga positiva que promueve la fusión de membranas a pH endosomal mientras que tienen una carga neutra a pH fisiológico. El lípido ionizable es necesario para encapsular el ARNm e impulsar el escape endosómico. El lípido PEGilado mejora la estabilidad de LNP y controla la interacción de
los LNP con proteínas y células sanguíneas. El colesterol y el fosfolípido contribuyen a la estabilidad de LNP y la desestabilización de la membrana endosomal.
Se ha informado que la administración intramuscular o subcutánea de mRNA LNP provoca respuestas de células T CD8 contra el antígeno codificado por mRNA. En estas estrategias, el ARNm se entrega a las células presentadoras de antígeno (APC) locales, lo que da como resultado niveles bajos a moderados de células T CD8 específicas de antígeno en la circulación. Sin embargo, para combatir eficazmente los tumores (especialmente en ubicaciones distantes) se requieren respuestas de células T CD8 potentes, duraderas y sistémicas. Se ha descrito que la administración intravenosa (iv) de vacunas de ARNm confiere respuestas mejoradas de células T e inmunidad antitumoral, lo que probablemente esté relacionado con su capacidad para movilizar las grandes reservas de APC presentes en el bazo. La inducción de fuertes respuestas de células T CD8 se ha confirmado clínicamente tras la inmunización iv de pacientes con melanoma metastásico con lipoplexos de ARNm compuestos por 1, 2-dioleoil-sn-glicero-3-fosfoetanolamina (DOPE) y el lípido catiónico DOTMA, pero aún no se ha utilizado en la clínica ninguna formulación basada en LNP para la vacunación terapéutica contra el cáncer por vía iv. Los LNP podrían mostrar una actividad aún más mejorada en comparación con los lipoplejos dado su potencial intrínseco mejorado para transfectar células. No obstante, las formulaciones estándar de LNP normalmente entregan ARN a los hepatocitos tras la administración iv, en lugar de las APC necesarias para estimular las células T CD8. En este estudio, especulamos que los LNP podrían adaptarse a la vacunación sistémica mediante la optimización de la relación molar entre los cuatro lípidos y la selección de un lípido de polietilenglicol (PEG) apropiado. Se sabe que estos parámetros afectan las características de LNP, como el tamaño, el potencial z, la farmacocinética y la biodistribución, que finalmente determinarán la inmunogenicidad in vivo. pero todavía no se ha usado en la clínica ninguna formulación basada en LNP para la vacunación terapéutica contra el cáncer por vía iv. Los LNP podrían mostrar una actividad aún más mejorada en comparación con los lipoplejos dado su potencial intrínseco mejorado para transfectar células. No obstante, las formulaciones estándar de LNP normalmente entregan ARN a los hepatocitos tras la administración iv, en lugar de las APC necesarias para estimular las células T CD8. En este estudio, especulamos que los LNP podrían adaptarse a la vacunación sistémica mediante la optimización de la relación molar entre los cuatro lípidos y la selección de un lípido de polietilenglicol (PEG) apropiado. Se sabe que estos parámetros afectan las características de LNP, como el tamaño, el potencial z, la farmacocinética y la biodistribución, que finalmente determinarán la inmunogenicidad in vivo. pero todavía no se ha usado en la clínica ninguna formulación basada en LNP para la vacunación terapéutica contra el cáncer por vía iv. Los LNP podrían mostrar una actividad aún más mejorada en comparación con los lipoplejos dado su potencial intrínseco mejorado para transfectar células. No obstante, las formulaciones estándar de LNP normalmente entregan ARN a los hepatocitos tras la administración iv, en lugar de las APC necesarias para estimular las células T CD8. En este estudio, especulamos que los LNP podrían adaptarse a la vacunación sistémica mediante la optimización de la relación molar entre los cuatro lípidos y la selección de un lípido de polietilenglicol (PEG) apropiado. Se sabe que estos parámetros afectan las características de LNP, como el tamaño, el potencial z, la farmacocinética y la biodistribución, que finalmente determinarán la inmunogenicidad in vivo. Los LNP podrían mostrar una actividad aún más mejorada en comparación con los lipoplejos dado su potencial intrínseco mejorado para transfectar células. No obstante, las formulaciones estándar de LNP normalmente entregan ARN a los hepatocitos tras la administración iv, en lugar de las APC necesarias para estimular las células T CD8. En este estudio, especulamos que los LNP podrían adaptarse a la vacunación sistémica mediante la optimización de la relación molar entre los cuatro lípidos y la selección de un lípido de polietilenglicol (PEG) apropiado. Se sabe que estos parámetros afectan las características de LNP, como el tamaño, el potencial z, la farmacocinética y la biodistribución, que finalmente determinarán la inmunogenicidad in vivo. Los LNP podrían mostrar una actividad aún más mejorada en comparación con los lipoplejos dado su potencial intrínseco mejorado para transfectar células. No obstante, las formulaciones estándar de LNP normalmente entregan ARN a los hepatocitos tras la administración iv, en lugar de las APC necesarias para estimular las células T CD8. En este estudio, especulamos que los LNP podrían adaptarse a la vacunación sistémica mediante la optimización de la relación molar entre los cuatro lípidos y la selección de un lípido de polietilenglicol (PEG) apropiado. Se sabe que estos parámetros afectan las características de LNP, como el tamaño, el potencial z, la farmacocinética y la biodistribución, que finalmente determinarán la inmunogenicidad in vivo. las formulaciones estándar de LNP generalmente entregan ARN a los hepatocitos en el momento de la administración iv, en lugar de las APC necesarias para estimular las células T CD8. En este estudio, especulamos que los LNP podrían adaptarse a la vacunación sistémica mediante la optimización de la relación molar entre los cuatro lípidos y la selección de un lípido de polietilenglicol (PEG) apropiado. Se sabe que estos parámetros afectan las características de LNP, como el tamaño, el potencial z, la farmacocinética y la biodistribución, que finalmente determinarán la inmunogenicidad in vivo. las formulaciones estándar de LNP generalmente entregan ARN a los hepatocitos en el momento de la administración iv, en lugar de las APC necesarias para estimular las células T CD8. En este estudio, especulamos que los LNP podrían adaptarse a la vacunación sistémica mediante la optimización de la relación molar entre los cuatro lípidos y la selección de un lípido de polietilenglicol (PEG) apropiado. Se sabe que estos parámetros afectan las características de LNP, como el tamaño, el potencial z, la farmacocinética y la biodistribución, que finalmente determinarán la inmunogenicidad in vivo.
Para diseñar y evaluar una variedad virtualmente ilimitada de posibles composiciones de LNP de manera rentable y en tiempo, adoptamos un enfoque de calidad por diseño basado en un diseño de experimento estadístico (DOE) acoplado a un modelo de regresión bayesiano. Esta estrategia nos permitió identificar los parámetros de composición clave que determinan la inmunogenicidad y predecir las composiciones óptimas de LNP dentro de una sola ronda de evaluación de inmunogenicidad in vivo. Composiciones óptimas de LNP
(dentro de las limitaciones del espacio de diseño) dio como resultado fuertes respuestas de células T CD8 que podrían potenciarse mediante la administración repetida y transmitieron eficacia antitumoral en un modelo de tumor TC-1 de ratón singénico. Los estudios mecanísticos revelaron que la respuesta de las células T dependía de la expresión inicial del ARNm por varias APC en el bazo y de la inducción de interferones tipo I (IFN). Sorprendentemente, también descubrimos un papel previamente no reconocido de las células B en la instigación de respuestas de células T CD8 específicas de antígeno tras la vacunación intravenosa de ARNm-LNP.
Bevers et al., Las vacunas mRNA-LNP ajustadas para la inmunización sistémica inducen una fuerte inmunidad antitumoral al involucrar a las células inmunes esplénicas, Molecular Therapy (2022), https://doi.org/10.1016/j.ymthe.2022.07.007