En el campo de las vacunas de ARNm y las terapias con ácidos nucleicos, las nanopartículas lipídicas (NPL) sirven como transportadores esenciales para la administración eficiente de ácidos nucleicos. Los materiales lipídicos son determinantes clave de la eficiencia y la bioseguridad de la administración de NPL. Sin embargo, la inestabilidad inherente del ARNm ha requerido desde hace tiempo que las formulaciones de NPL se almacenen a bajas temperaturas. Los cristales de hielo y el estrés osmótico generados durante los ciclos de congelación-descongelación pueden provocar fácilmente la agregación de NPL y la fuga de ARNm, lo que limita gravemente su aplicación práctica.
Un equipo del Instituto de Química de la Academia China de Ciencias publicó una investigación en Nature Communications, donde propone una solución novedosa: aprovechar el fenómeno de la congelación-concentración para incorporar activamente crioprotectores basados en betaína (CPA) en las LNP. Este enfoque no solo mantiene la estabilidad de la formulación, sino que también mejora significativamente la eficiencia de la administración del ARNm. El estudio ofrece una nueva perspectiva para optimizar las formulaciones basadas en lípidos.

Antecedentes de la investigación
El ARNm es muy sensible a la hidrólisis, la oxidación y la degradación enzimática, lo que requiere un almacenamiento a temperaturas bajo cero para su estabilidad. Las vacunas de ARNm de uso clínico, como la ARNm-1273 y la BNT162b2, emplean sacarosa como crioprotector. Sin embargo, incluso con crioprotectores, persisten dos problemas fundamentales durante los ciclos de congelación-descongelación:
-
Alteración de la estabilidad física: la formación de cristales de hielo y los cambios de presión osmótica pueden provocar la fusión y agregación de LNP, comprometiendo su estructura esférica y la uniformidad de tamaño.
-
Eficiencia de administración reducida: el daño estructural a los LNP puede provocar una fuga de ARNm y un escape endosómico debilitado, lo que en última instancia reduce la eficiencia de la expresión del ARNm en las células objetivo.
Si bien la investigación existente se centra principalmente en la "estabilización pasiva" de LNP, este estudio utiliza de manera innovadora el propio proceso de congelación y descongelación para transformar los crioprotectores de simples "estabilizadores" en "potenciadores funcionales", logrando mejoras duales en la estabilidad y la eficiencia de administración.
La congelación-concentración impulsa la incorporación de BT-CPA en LNP
El equipo de investigación desarrolló un crioprotector compuesto (BT-CPA) compuesto de betaína y trehalosa. Mediante una serie de experimentos, demostraron que la congelación induce la incorporación activa del BT-CPA a las LNP, logrando dos efectos clave: (1) mantener la integridad estructural de las LNP tras ciclos de congelación-descongelación, y (2) mejorar la capacidad de escape endosómico de las LNP, lo que aumenta la eficiencia de la administración del ARNm.
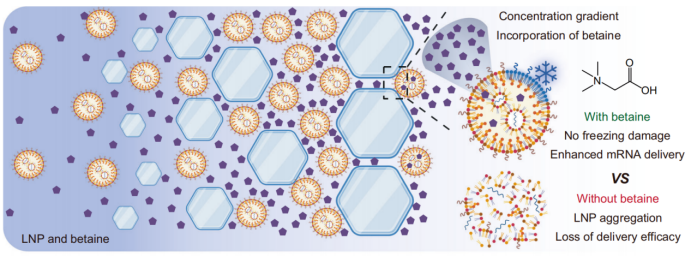
Durante la congelación, el agua forma cristales de hielo, lo que provoca un aumento brusco de las concentraciones de LNP y crioprotectores en la fase líquida restante, un fenómeno denominado "concentración por congelación". Este proceso crea un pronunciado gradiente de concentración a través de la membrana de LNP, lo que impulsa la difusión pasiva de betaína y trehalosa hacia el interior de las LNP a través de huecos transitorios en la membrana lipídica (inducidos por la tensión mecánica de los cristales de hielo y las transiciones de fase lipídica).
Los investigadores validaron este mecanismo mediante resonancia magnética nuclear de protones (RMN¹H) y espectrometría de masas de alta resolución: En muestras de LNP+BT-CPA sometidas a ciclos de congelación-descongelación, se detectaron señales características de betaína (picos a 3,28 ppm y 3,83 ppm) y trehalosa (p. ej., pico a 3,34 ppm) incluso después de la diálisis para eliminar el BT-CPA libre externo. Por el contrario, las muestras de LNP+BT-CPA no sometidas a ciclos de congelación-descongelación mostraron una encapsulación mínima de BT-CPA. Esto confirma que la congelación es necesaria para la incorporación de BT-CPA a las LNP, más allá de la simple adsorción superficial.
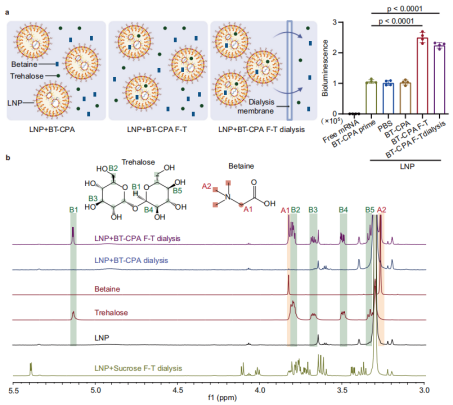
Optimización de BT-CPA: Control preciso de la concentración y la proporción
Para equilibrar la estabilidad y la eficiencia de administración, los investigadores optimizaron sistemáticamente la concentración y la proporción de BT-CPA:
-
Optimización de la proporción compuesta: El uso de 25 mg/mL de betaína sola mantuvo la estabilidad de las LNP, pero la eficiencia de encapsulación del ARNm fue ligeramente inferior a la de 87 mg/mL de sacarosa. La adición de 25 mg/mL de trehalosa (es decir, BT-CPA: 25 mg/mL de betaína + 25 mg/mL de trehalosa) resultó en cambios mínimos en el tamaño de las LNP tras la congelación-descongelación, una eficiencia de encapsulación del ARNm estable y un aumento de 1,4 veces en la eficiencia de administración en comparación con la betaína sola y de 2,4 veces con respecto a las LNP frescas.
-
Efecto del umbral de concentración: el aumento de la concentración de betaína de 10 mg/mL a 25 mg/mL mejoró significativamente la eficiencia de administración del ARNm, pero aumentos adicionales a 75 mg/mL no produjeron ganancias adicionales, lo que estableció 25 mg/mL como la concentración óptima.
-
Optimización del ciclo de congelación y descongelación: 1 o 2 ciclos mejoraron la eficiencia de administración sin dañar la estructura de LNP, mientras que 6 ciclos provocaron agregación de LNP, fuga de ARNm y redujeron la eficiencia, identificando 2 ciclos como óptimos.
BT-CPA mejora la administración de ARNm al potenciar el escape endosómico
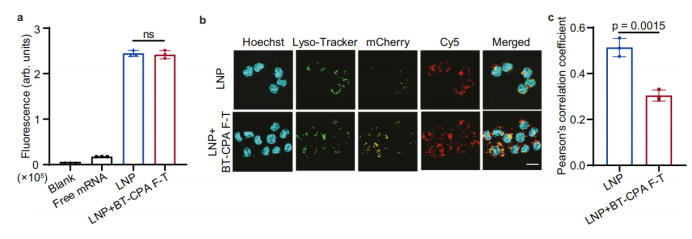
A través de experimentos celulares y validación mecanicista, los investigadores aclararon que BT-CPA mejora la eficiencia de administración no al afectar la captación celular sino al mejorar el escape endosómico para aumentar la expresión del ARNm.
-
Captación celular sin cambios, mayor escape endosómico: La citometría de flujo mostró que la eficiencia de captación celular de los LNP de SM-102 tratados con BT-CPA y congelación-descongelación (LNP de BT-CPA) fue casi idéntica a la de los LNP de SM-102 frescos. Sin embargo, la microscopía confocal reveló una superposición significativamente menor entre el ARNm marcado con Cy5 (rojo) y los marcadores lisosomales (verde) en los LNP de BT-CPA, con un coeficiente de correlación de Pearson (PCC) significativamente menor que el de los LNP frescos, lo que indica un mayor escape endosómico.
-
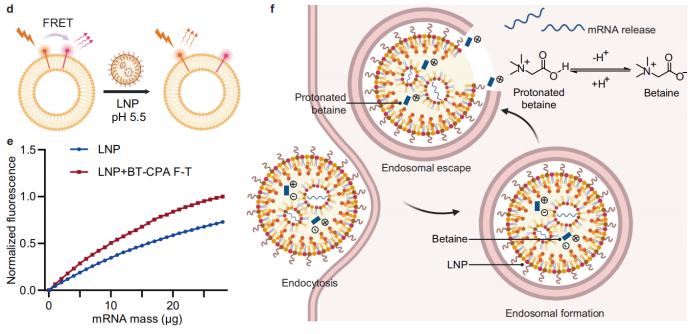
Mecanismo molecular: La protonación de la betaína media la fusión de membranas: La betaína, una molécula zwitteriónica, se protona en el entorno endosómico ácido, adquiriendo carga positiva y promoviendo interacciones electrostáticas con las membranas endosómicas negativas para facilitar la fusión. Experimentos de fusión de membranas con endosomas modelo marcados con NBD-PE y Rhod-PE mostraron una mayor desactivación de la fluorescencia de NBD en las LNP BT-CPA, lo que confirma una mayor capacidad de fusión.
-
Universalidad: Compatibilidad con múltiples lípidos: El efecto potenciador de BT-CPA no se limita a SM-102, sino que se aplica a diversos lípidos ionizables de uso clínico (p. ej., ALC-0315, MC3). Las LNP preparadas con estos lípidos mostraron una eficiencia de administración de ARNm significativamente mejorada tras el tratamiento con BT-CPA y la congelación-descongelación, con tamaños de partícula inferiores a 200 nm y un PDI < 0,2, lo que demuestra una amplia aplicabilidad.
Validación in vivo: mayor respuesta inmunitaria y ventaja en el ahorro de dosis
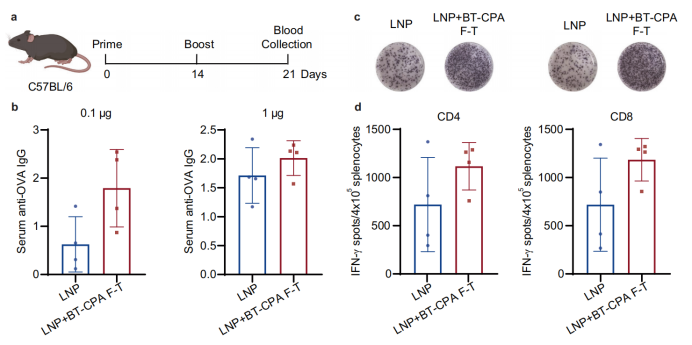
En ratones C57BL/6, los BT-CPA-LNP exhibieron ventajas significativas:
-
Mayor expresión de ARNm: a las 4 y 24 horas posteriores a la inyección intramuscular, la expresión de luciferasa en las LNP de BT-CPA fue 2,3 y 1,7 veces mayor que en las LNP frescas, respectivamente.
-
Respuesta inmune más fuerte: Los BT-CPA-LNP que encapsulan el ARNm de ovoalbúmina (mOVA) indujeron títulos de anticuerpos IgG específicos de OVA significativamente más altos en dosis de 0,1 μg y 1 μg, y los ensayos ELISpot mostraron un aumento de células T CD4⁺ y CD8⁺ positivas para IFN-γ.
-
Excelente estabilidad a largo plazo: después de 6 meses a -80 °C, las BT-CPA-LNP mantuvieron una alta eficiencia de expresión de ARNm con baja citotoxicidad (viabilidad celular DC2.4 > 90 %).
Importancia de la investigación
Este estudio no solo propone una nueva estrategia de crioprotección de LNP, sino que también redefine los crioprotectores como «componentes activos» que pueden incorporarse a las LNP durante la congelación para regular su función. Las contribuciones clave incluyen:
-
Optimización de los protocolos de almacenamiento: abordar los desafíos de estabilidad en el almacenamiento y transporte de LNP a baja temperatura, apoyando la distribución global de vacunas de ARNm y medicamentos de ácido nucleico.
-
Ampliación de las aplicaciones de lípidos: demostración de que lípidos como SM-102, ALC-0315 y MC3 pueden lograr una mejor administración a través de BT-CPA, lo que ayuda a las aplicaciones en inmunoterapia contra el cáncer y terapia genética.
-
Diseño innovador de formulaciones: pioneros en el concepto de "aprovechar la congelación para la mejora funcional", ofreciendo un nuevo paradigma para el desarrollo de LNP.
Conclusión
Al utilizar estratégicamente el proceso de congelación, esta investigación transforma los desafíos del almacenamiento de LNP en ventajas funcionales, proporcionando una valiosa solución técnica para optimizar las formulaciones de lípidos centrales como SM-102, ALC-0315 y MC3, con implicaciones prometedoras para el tratamiento de enfermedades
SINOPEG suministra los lípidos utilizados en el estudio (SM-102, ALC-0315, MC3), ofreciendo excipientes liposómicos integrales y una gama de excipientes lipídicos patentados. También ofrecemos polisacáridos y productos polizwitteriónicos de alta calidad para satisfacer diversas necesidades de I+D y producción.
Referencia
Cheng X, Zheng X, Tao K, et al. La incorporación de betaína inducida por congelación en nanopartículas lipídicas mejora la administración de ARNm. Nature Communications. 2025;16(1):4700
Acerca de nosotros
SINOPEG proporciona soluciones integrales de adquisición eficientes en administración de fármacos, productos biofarmacéuticos y ciencia de los materiales
Plataformas tecnológicas y productos principales:
-
Derivados de PEG farmacéuticos/médicos: PEG lineales y estructurados (multibrazo, en forma de V, en forma de Y, etc.).
-
Modificadores de la cadena lateral de ácidos grasos: cadenas laterales de semaglutida, liraglutida, tirzepatida y enlaces peptídicos.
-
Plataforma de lípidos (LNP): lípidos LNP de vacuna de ARNm integral, incluidos lípidos catiónicos patentados.
-
Plataforma de enlace ADC/ProTAC: enlazadores listos para usar y personalizados.
-
Plataforma de copolímeros en bloque: portadores de administración de fármacos en micelas macromoleculares.
Certificadas según ISO9001/13485/14001/45001, EcoVadis y GB/T29490, nuestras instalaciones cumplen con los estándares cGMP y las pautas ICH-Q7A, lo que garantiza productos y servicios de alta calidad para clientes globales.