Comparación de dos enfoques para la unión de un fármaco a nanopartículas de oro y sus actividades anticancerígenas
2024-04-25
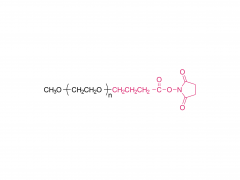
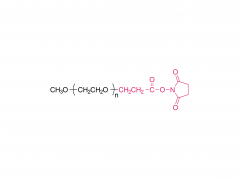
Mol. Pharmaceutics 2016, 13, 9, 3308–3317 12 de agosto de 2016 https://doi.org/10.1021/acs.molpharmaceut.6b00619 Comparación de dos enfoques para la unión de un fármaco a nanopartículas de oro y sus actividades anticancerígenas Yingjie Fu†, Qishuai Feng‡, Yifan Chen‡, Yajing Shen‡, Qihang Su‡, Yinglei Zhang‡, Xiang Zhou*† y Yu Cheng*‡ Resumen La conexión de fármacos es importante en la administración de fármacos para la quimioterapia contra el cáncer. El esclarecimiento del mecanismo de liberación y el comportamiento biológico de un fármaco es esencial para el diseño de sistemas de administración. Aquí, utilizamos un enlace hidrazona o un enlace amida para unir un fármaco anticancerígeno, la doxorrubicina (Dox), a nanopartículas de oro (GNP) y comparamos los efectos del enlace químico sobre las actividades anticancerígenas de las Dox-GNP resultantes. La eficiencia de liberación del fármaco, la citotoxicidad, la distribución subcelular y la apoptosis celular de los HDox-GNP unidos a hidrazona y los SDox-GNP unidos a amida se evaluaron en varias células cancerosas. Los HDox-GNP mostraron una mayor potencia para la administración de fármacos a través de una liberación provocada por pH ácido y glutatión (GSH) que los SDox-GNP desencadenados por GSH solo. La dox liberada de HDox-GNP se liberó en los lisosomas y ejerció su actividad farmacológica al ingresar a los núcleos. Dox de SDox-GNP se localizó principalmente en lisosomas, lo que redujo significativamente su eficacia contra las células cancerosas. Además, los estudios in vivo en ratones con tumores demostraron que tanto HDox-GNP como SDox-GNP se acumulan en el tejido tumoral. Sin embargo, solo los HDox-GNP mejoraron la inhibición del crecimiento del tumor subcutáneo. Este estudio demuestra que los HDox-GNP muestran ventajas significativas en la liberación de fármacos y la eficacia antitumoral. PALABRAS CLAVE: nanopartícula de oro, doxorrubicina, administración de fármacos, actividad anticancerígena Productos relacionados Abreviatura: MeO-PEG-SH Para obtener más información sobre el producto, comuníquese con nosotros en: Tel. EE. UU.: 1-844-782-5734 Tel. EE. UU.: 1-844-QUAL- PEG CHN Tel: 400-918-9898 Correo electrónico: sales@sinopeg.com
ver más