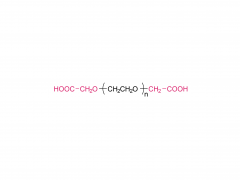
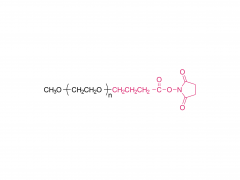
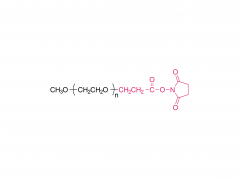
Cultivos y Productos Industriales. Volumen 152, 15 de septiembre de 2020, 112497 https://doi.org/10.1016/j.indcrop.2020.112497 Nanopartículas de carboximetilcelulosa cargadas con avermectina con propiedades de respuesta a estímulos y liberación controlada Huaxin Zhu, Yue Shen, Jianxia Cui, Anqi wang, Ningjun Li , Chong Wang, Bo Cui, Changjiao Sun, Xiang Zhao, Chunxin Wang, Fei Gao, Shenshan Zhan, Liang Guo, Liang Zhang, Zhanghua Zeng, Yan Wang, Haixin Cui Abstracto Se introdujo polietilenglicol (PEG) en carboximetilcelulosa (CMC) para formar una cadena hidrófila de PEG-CMC. Se injertó avermectina (Avm) en la cadena larga de PEG-CMC mediante el uso de N,N-diciclohexilcarbodiimida (DCC) como deshidratante y 4-dimetilaminopiridina (DMAP) como catalizador para formar la molécula anfifílica. Luego, las nanopartículas de avermectina se prepararon con liberación sostenida sensible a la esterasa con éxito a través del autoensamblaje. El tamaño de las nanopartículas era inferior a 400 nm. La carga de avermectina fue del 8 % y la tasa de degradación fue inferior al 50 % bajo la lámpara de arco de xenón durante 72 h. En comparación con la técnica de avermectina, mostró una clara ventaja contra la fotodegradación. En comparación con los gránulos dispersables en agua (WDG) comercialmente disponibles, las nanopartículas de avermectina tenían un ángulo de contacto más pequeño en la superficie de la hoja de pepino y hubo una diferencia significativa. La prueba de toxicidad mostró que las nanopartículas tienen cierto efecto insecticida sobre la larva de Hyphantria cunea y la sensibilidad aumentó gradualmente con el tiempo. Productos relacionados Abreviatura: mPEG-CM Nombre: metoxipoli(etilenglicol) carboximetilo Para obtener más información sobre el producto, contáctenos en: Tel. EE. UU.: 1-844-782-5734 Tel. EE. UU.: 1-844-QUAL-PEG Tel. CHN: 400-918-9898 Correo electrónico: sales@sinopeg.com
ver más