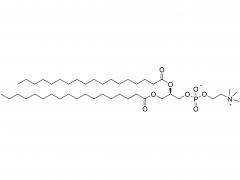
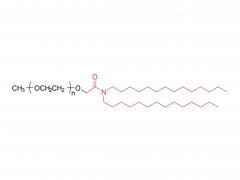
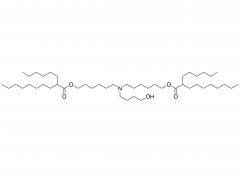
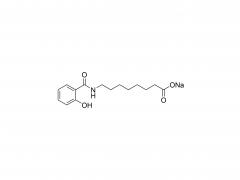
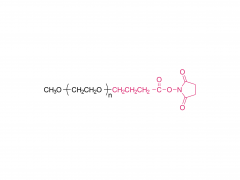
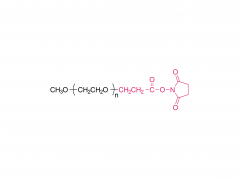
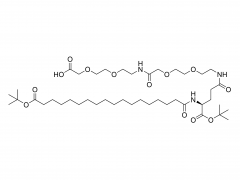
J Exp Med. 1 de septiembre de 2025;222(9):e20241454. doi: 10.1084/jem.20241454. Publicación electrónica 6 de junio de 2025. La vacuna de ARNm con adyuvante de membrana-IL12 polariza las células T preefectoras para optimizar el control tumoral. Abstracto Las vacunas convencionales de ARNm contra el cáncer pueden aumentar la cantidad de linfocitos T CD8+ específicos del tumor, pero su función efectora podría verse comprometida. La señalización de citocinas específicas puede mejorar la diferenciación de los linfocitos T para una mejor destrucción tumoral. Analizamos diversas citocinas e identificamos la IL-12 como un potente adyuvante para las vacunas de ARNm, aunque con una toxicidad sistémica significativa. Para equilibrar la eficacia y la toxicidad, desarrollamos una vacuna de ARNm adyuvante con IL-12 unida a la membrana (mtIL12). Este diseño restringe la expresión de mtIL12 a la superficie de las células presentadoras de antígeno, activando así selectivamente los linfocitos T específicos del antígeno sin afectar a los linfocitos T o NK transeúntes. La vacunación con ARNm adyuvante con mtIL12 indujo un subconjunto único de linfocitos T preefectores que da lugar a linfocitos T efectores altamente sensibles, lo que resulta en una actividad antitumoral superior. Además, este enfoque superó la resistencia a la terapia de puntos de control inmunitario y previno la metástasis del cáncer. Nuestro estudio destaca que las vacunas de ARNm de próxima generación que codifican adyuvantes de citocinas unidos a la membrana pueden generar potentes células T efectoras, ofreciendo un control tumoral eficaz con toxicidad reducida. Producto: Excipientes al por mayor para la administración de ADN/ARN, proveedores profesionales de excipientes para la administración de ADN/ARN.
ver más