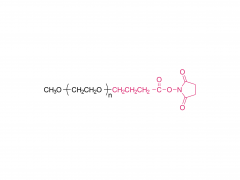
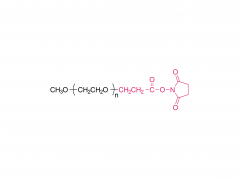
PEG4, PEG8, PEG24 | Efecto de los espaciadores de polietilenglicol, alquilo y oligonucleótidos en la unión, la estructura secundaria y el autoensamblaje de los aptámeros-anfifilos FKN-S2 que se unen a la fractalquina
2025-09-09
Langmuir. 1 de julio de 2014;30(25):7465-74. doi: 10.1021/la500403v. Publicación electrónica 17 de junio de 2014. Efecto de los espaciadores de polietilenglicol, alquilo y oligonucleótidos en la unión, la estructura secundaria y el autoensamblaje de los aptámeros-anfifilos FKN-S2 que se unen a la fractalquina Abstracto Previamente identificamos un aptámero, llamado FKN-S2, que se une a la proteína de superficie celular fractalquina con alta afinidad y especificidad. En este artículo se añadió una cola dialquil C16 hidrofóbica al aptámero para crear un aptámero-anfifílico. Investigamos cómo la cola y una molécula espaciadora de longitud e hidrofobicidad variables, insertada entre la cola y el grupo de cabeza del aptámero, afectan la unión, la estructura y las propiedades de autoensamblaje del aptámero-anfifílico. Sintetizamos aptámeros-anfifílicos sin espaciador (NoSPR), polietilenglicol (PEG4, PEG8, PEG24), alquilo (C12 y C24) u oligonucleótidos (T10 y T5: 10 y 5 timina, y A10: 10 adenina). La adición de la cola redujo la afinidad de unión del aptámero-anfifílico más de 7,5 veces en comparación con el aptámero libre. Los espaciadores de alquilo hidrofóbicos resultaron en la mayor pérdida de afinidad, y los espaciadores de PEG hidrofílicos mejoraron la afinidad anfifílica pero no la restauraron a la del aptámero libre. Curiosamente, los espaciadores de oligonucleótidos produjeron los anfifilos de mayor afinidad. Sin embargo, la composición de nucleótidos no afectó la afinidad, ya que los espaciadores T10 y A10 tuvieron la misma afinidad. Los anfifilos del espaciador de oligonucleótidos tuvieron la mayor afinidad porque el espaciador de oligonucleótidos aumentó la afinidad del aptámero libre; el aptámero FKN-S2 más el espaciador de oligonucleótidos tuvo una mayor afinidad que el aptámero FKN-S2 libre. La espectroscopia de dicroísmo circular (CD) y los estudios de fusión térmica indicaron que el aptámero forma un tallo-bucle y un G-cuadrúplex intramolecular, y la cola estabilizó fuertemente la formación del G-cuadrúplex en un tampón. La microscopía electrónica de transmisión criogénica (crio-TEM) mostró que los aptámeros-anfífilos, independientemente del espaciador utilizado, se autoensamblaban en micelas y nanocintas, estructuras bicapa planas que a menudo presentaban torsión. Finalmente, los liposomas funcionalizados con el anfífilo FKN-S2 se incubaron con células que expresaban fractalquinas, y el grado de unión dependió de la concentración del anfífilo en la superficie del liposoma.
ver más